BB-DARS
BB-DARS: Blut-Biomarker-DrAinage-Reserve-Score zur personalisierten Risikoab-schätzung einer ARIA unter Aß-Immuntherapie
In klinischen Studien der neuartigen Amyloid-ß-Antikörpertherapien (Aß-Immuntherapie) zur Behandlung der Alzheimer Erkrankung wurde bei 40% der behandelten Patienten als unerwünschte Therapiefolge eine akute Hirnschädigung in Form von Hirnblutungen und Ödembildungen beobachtet, die sich magnetresonanztomographisch (MRT) als „Amyloid-related imaging abnormalities“ (ARIA) darstellt. Ursächlich für das Auftreten einer ARIA wird eine komorbide Störung des perivaskulären Drainagesystems (Abbildung 1), welches für den Abtransport toxischer Substanzen zuständig ist, angesehen. Das Vorliegen einer Drainagestörung, und damit das Risiko eine ARIA unter Aß-Immuntherapie zu entwickeln, lässt sich mittels MRT untersuchen. Allerdings kann bei zahlreichen Patienten der Alzheimer Erkrankung aus verschiedenen Gründen die notwendige MRT-Untersuchung nicht durchgeführt werden. In Zusammenarbeit mit dem Universitätsklinikum Düsseldorf wollen wir daher durch proteomische Analysen, einen innovativen Blut-Biomarker für das Vorliegen einer Drainagestörung identifizieren, der künftig flächendeckend bei möglichst allen Patienten einer Alzheimer Erkrankung zur Risikoeinschätzung für das Auftreten einer ARIA unter Aß-Immuntherapie eingesetzt werden kann.
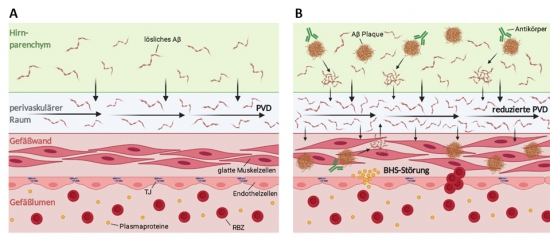
Abbildung 1: Pathophysiologie der ARIA ("Amyloid related imaging abnormalities"). Im physiologischen Zustand (A) wird Amyloid-β (Aβ) über perivaskuläre Räume aus dem Gehirn abtransportiert. (B) Bei der Alzheimer Erkrankung unter Immuntherapie (und gleichzeitig vorliegender, gestörten perivaskulären Drainage, PVD) führt die Akkumulation von Aβ in der Gefäßwand zu einer gestörten Gefäßintegrität inkl. einer Blut-Hirn-Schranken (BHS)-Störung mit Verringerung der Tight-Junction-Proteine (TJ), Erhöhung der Gefäßwanddurchlässigkeit, u.a. für Erythrozyten (rote Blutzellen, RBZ), Ödembildungen (ARIA-E) und Blutungen (ARIA-H). Modifiziert nach Greenberg et al. 202019 und aus Henneicke et al. "Die inflammatorische Variante der Zerebralen Amyloidangiopathie – ein Update", Ärztliche Praxis Neurologie Psychiatrie.
Projekt-Team
- Prof. Dr. med. Stefanie Schreiber (Universitätsklinik für Neurologie)
- Dr. Katja Neumann (Universitätsklinik für Neurologie)
- Prof. Dr. med. Daniel Behme (Universitätsklinik für Neuroradiologie)
- Dr. Hendrik Mattern (Otto-von-Guericke-Universität Magdeburg - Abteilung biomedizinische Magnetresonanz)
- PD Dr. med. Marc Pawlitzki (Uniklinik Düsseldorf)
- Prof. Dr. med. Dr. rer. nat. Dr. h. c. Sven Meuth (Universitätsklinik Düsseldorf)
Dieses Projekt wird von der Deutschen Alzheimer Gesellschaft e. V. und der Förderstiftung Dierichs über den Zeitraum 01.10.2024 – 30.09.2026 gefördert.
Referenzen
van Dyck, C. H. et al. Lecanemab in Early Alzheimer's Disease. N Engl J Med 388, 9-21, doi:10.1056/NEJMoa2212948 (2023).
Gueorguieva, I. et al. Donanemab Population Pharmacokinetics, Amyloid Plaque Reduction, and Safety in Participants with Alzheimer's Disease. Clin Pharmacol Ther 113, 1258-1267, doi:10.1002/cpt.2875 (2023).
Heidebrink, J. L. & Paulson, H. L. Lessons Learned from Approval of Aducanumab for Alzheimer's Disease. Annu Rev Med 75, 99-111, doi:10.1146/annurev-med-051022-043645 (2024).
Salloway, S. et al. Amyloid-Related Imaging Abnormalities in 2 Phase 3 Studies Evaluating Aducanumab in Patients With Early Alzheimer Disease. JAMA Neurol 79, 13-21, doi:10.1001/jamaneurol.2021.4161 (2022).
Muir, R. T., Ismail, Z., Black, S. E. & Smith, E. E. Comparative methods for quantifying plasma biomarkers in Alzheimer's disease: Implications for the next frontier in cerebral amyloid angiopathy diagnostics. Alzheimers Dement, doi:10.1002/alz.13510 (2023).
Solopova, E. et al. Fatal iatrogenic cerebral β-amyloid-related arteritis in a woman treated with lecanemab for Alzheimer’s disease. Nature Communications 14, 8220, doi:10.1038/s41467-023-43933-5 (2023).
Duperron, M. G. et al. Genomics of perivascular space burden unravels early mechanisms of cerebral small vessel disease. Nat Med 29, 950-962, doi:10.1038/s41591-023-02268-w (2023)
Neumann, K., Günther, M., Düzel, E. & Schreiber, S. Microvascular Impairment in Patients With Cerebral Small Vessel Disease Assessed With Arterial Spin Labeling Magnetic Resonance Imaging: A Pilot Study. Front Aging Neurosci 14, 871612, doi:10.3389/fnagi.2022.871612 (2022).





